Quimica e suas transformações
Esse blog foi criado com intuito de fornecer àqueles que se interessam pela disciplina de química, subsídios para um melhor aprofundamento e/ou sanar dúvidas correlatas à química. Aqui serão postados, principalmente, os fenômenos de transformações fisícas que ocorrem com os elementos como: Osmose, Crioscopia, Ebulioscopia etc;
quarta-feira, 11 de julho de 2012
domingo, 20 de maio de 2012
EXPERIMENTO PRÁTICO DE CRIOSCOPIA
1. Objetivo
Observar o efeito da adição de um soluto em água e seu
ponto de congelamento.
2. Introdução
Vamos aprender
de uma maneira rápida e prática a definição e a classificação das propriedades
coligativas.
Sabemos que a
água pura congela a 0°C
e ferve a 100°C ,
sob pressão de 1 atm. Porém se adicionarmos uma pequena quantidade de sal, ela
passa a congelar abaixo de 0°C
e ferver acima de 100°C .
Assim como acontece com a água, tal fato também acontece com outros solventes. O
que é provocado pelo sal, também é provocado por outros solutos, desde que eles
sejam não voláteis.
Tais fenômenos
(abaixamento da temperatura de congelamento, aumento da temperatura de
ebulição, diminuição da pressão de vapor) são denominados propriedades coligativas das soluções.
É interessante notar que tais fenômenos dependem
apenas do número de partículas (moléculas ou íons) dissolvidas na solução, não
dependendo da natureza do soluto. Assim se dissolvermos Y moléculas de açúcar
em 1litro de água e Y íons em outro recipiente com 1 litro de água, a
diminuição da temperatura de congelamento será a mesmo em ambos os casos.
As moléculas de um líquido têm certa liberdade de
movimento, que aumenta com o aquecimento do líquido e diminui com o abaixamento
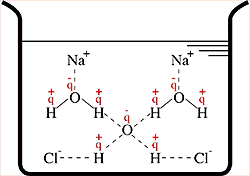
da temperatura. Quando um sólido não volátil (NaCl) é dissolvido num líquido, a
temperatura de congelamento é inferior à que se observa para o líquido puro. Essa
variação do ponto de congelamento é chamada de Crioscopia e depende da relativa proporção entre moléculas do
soluto e do solvente.
3. Materiais necessários
Termômetro simples Água
Espátula Béquer (copos descartáveis/vasilhames)
Sal de cozinha (NaCl) Gelo
Cronômetro
Metodologia
Coloque gelo em um recipiente grande que caiba outros três recipientes menores.
Coloque água em três recipientes até enchê-los.
Identifique: No
primeiro recipiente coloque 3 colheres de chá de sal de cozinha, no segundo coloque
5 colheres de sal e no terceiro deixe somente com água pura.
5 colheres de sal e no terceiro deixe somente com água pura.
Introduza os 3 recipientes no recipiente maior com gelo, de forma que o conteúdo dos outros três
recipientes fique submerso. Deixe em repouso por cerca de 5 minutos, retire e observe. Retorne ao
recipiente com gelo caso não tenha congelado e observe a cada 1 minuto.
recipientes fique submerso. Deixe em repouso por cerca de 5 minutos, retire e observe. Retorne ao
recipiente com gelo caso não tenha congelado e observe a cada 1 minuto.
Verifique a ordem
de congelamento da água nos três tubos.
Anote o tempo de congelamento dos 3
tubos de ensaio.
Propriedades Coligativas
São propriedades que estão intimamente relacionadas com o número de partículas de um soluto disperso em uma solução. Isso ocorre devido ao aumento das forças intermoleculares que influenciam diretamente no comportamento da solução frente ao aquecimento, congelamento e quantidade de vapor do solvente produzido.
Solução de NaCl em água.
As propriedades coligativas são:
Abaixamento da pressão máxima de vapor do solvente Tonoscopia e tonometria
Aumento da temperatura de ebulição do solvente Ebulioscopia e ebuliometria
Abaixamento da temperatura de congelação do solvente Crioscopia e criometria
Pressão osmótica Osmoscopia e osmometria
Embasamento Científico
- LEI DE RAOULT
Em 1878 o químico francês François-Marie Raoult (1830-1901) afirma que o efeito coligativo de um soluto não volátil molecular em um solvente é diretamente proporcional à molalidade da solução:
Efeito Coligativo = K . W
onde:
K = constante de proporcionalidade
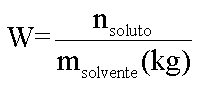
Portanto para os efeitos coligativos teremos:
Tonoscopia
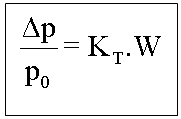
Onde: KT=Constante tonoscópica molal (Msolvente/1000)
Ebulioscopia
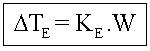
Onde: Ke=Constante ebulioscópia molal (Msolvelte/1000)
Crioscopia
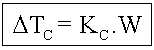
Onde: Kc=Constante crioscópica molal (Msolvente/1000)
- LEI DE VAN´T HOFF PARA OSMOSE
1a) A pressão osmótica é diretamente proporcional à temperatura absoluta da solução:
2a) A pressão osmótica é diretamente proporcional à concentração molar da solução:
Juntando-se as duas leis pela proporcionalidade mútua, obtém-se:
Sabendo-se que 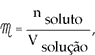
Assinar:
Postagens (Atom)