São propriedades que estão intimamente relacionadas com o número de partículas de um soluto disperso em uma solução. Isso ocorre devido ao aumento das forças intermoleculares que influenciam diretamente no comportamento da solução frente ao aquecimento, congelamento e quantidade de vapor do solvente produzido.
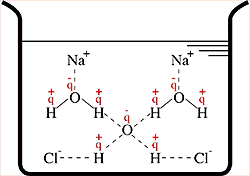
Solução de NaCl em água.
As propriedades coligativas são:
Abaixamento da pressão máxima de vapor do solvente Tonoscopia e tonometria
Aumento da temperatura de ebulição do solvente Ebulioscopia e ebuliometria
Abaixamento da temperatura de congelação do solvente Crioscopia e criometria
Pressão osmótica Osmoscopia e osmometria
Embasamento Científico
- LEI DE RAOULT
Em 1878 o químico francês François-Marie Raoult (1830-1901) afirma que o efeito coligativo de um soluto não volátil molecular em um solvente é diretamente proporcional à molalidade da solução:
Efeito Coligativo = K . W
onde:
K = constante de proporcionalidade
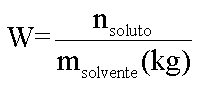
Portanto para os efeitos coligativos teremos:
Tonoscopia
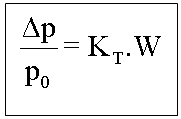
Onde: KT=Constante tonoscópica molal (Msolvente/1000)
Ebulioscopia
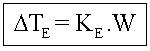
Onde: Ke=Constante ebulioscópia molal (Msolvelte/1000)
Crioscopia
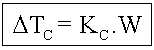
Onde: Kc=Constante crioscópica molal (Msolvente/1000)
- LEI DE VAN´T HOFF PARA OSMOSE
1a) A pressão osmótica é diretamente proporcional à temperatura absoluta da solução:
2a) A pressão osmótica é diretamente proporcional à concentração molar da solução:
Juntando-se as duas leis pela proporcionalidade mútua, obtém-se:
Sabendo-se que 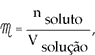
Nenhum comentário:
Postar um comentário